医疗器械生产监督检查再次强化,重点监管品种已出炉。
近期,江苏省药监局发布《江苏省医疗器械生产分级监管实施办法》(以下简称《办法》),其中明确,4月7日起执行医疗器械生产分级监管。
分级监管是指根据医疗器械的风险程度以及医疗器械注册人备案人、受托生产企业的质量管理水平,结合医疗器械不良事件、企业监管信用及产品质量投诉状况等因素,将医疗器械注册人备案人、受托生产企业分为不同的级别,按照风险分级、科学监管,全面覆盖、动态调整,落实责任、提升效能的原则,实施属地化分级动态管理的活动。
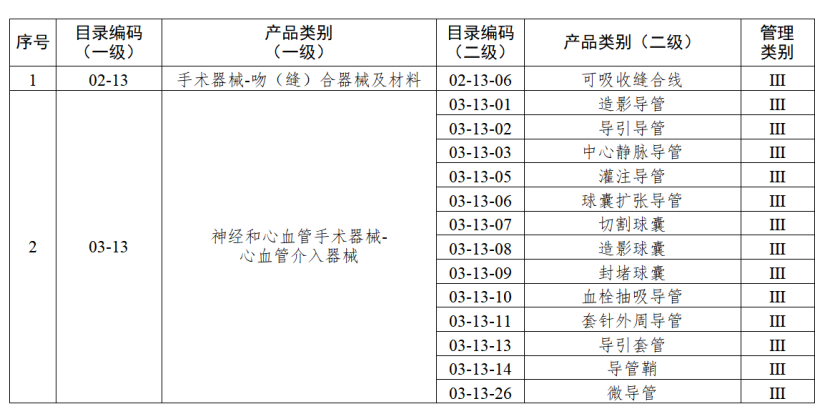
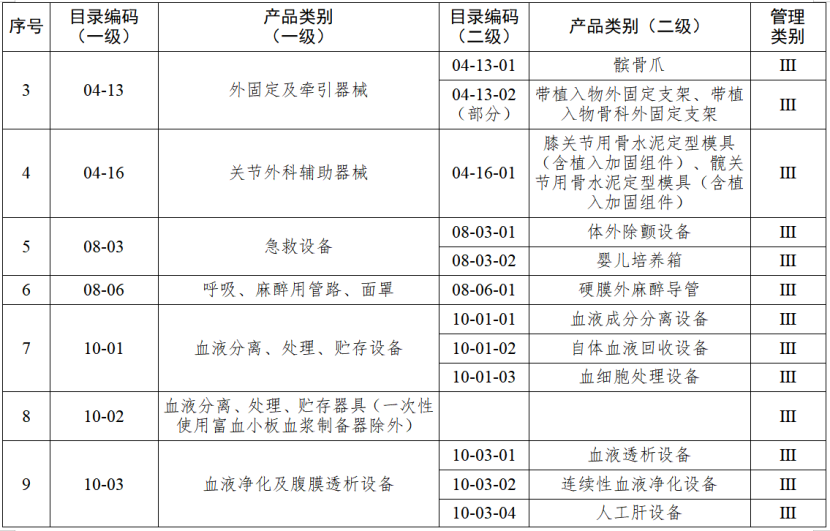
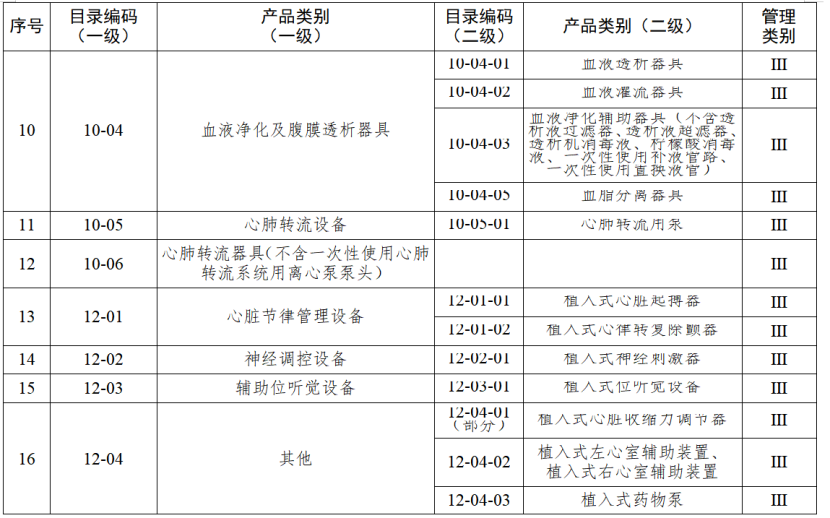
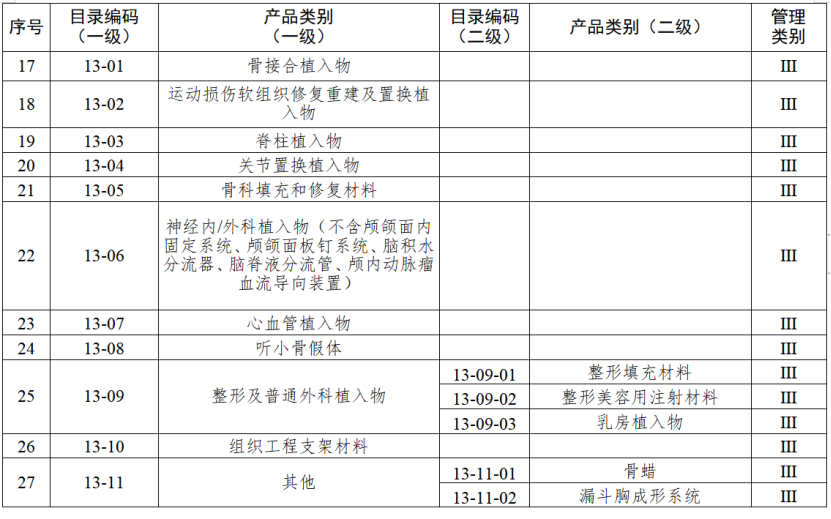
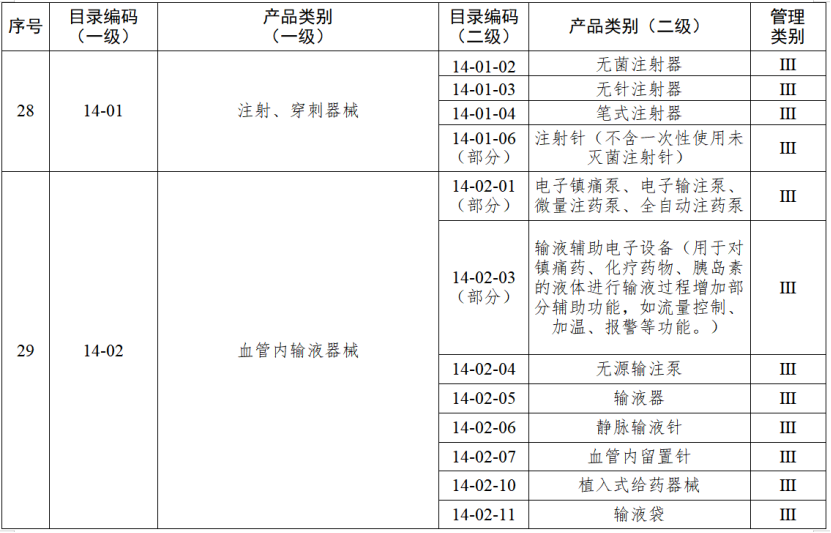
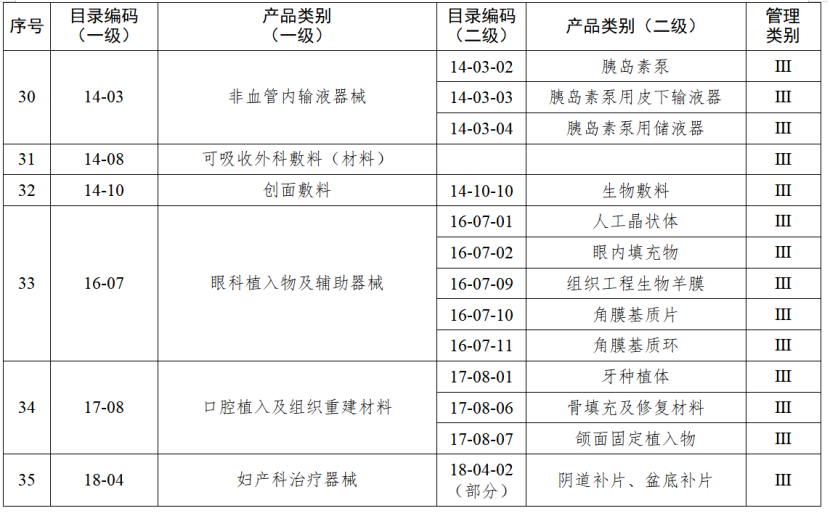
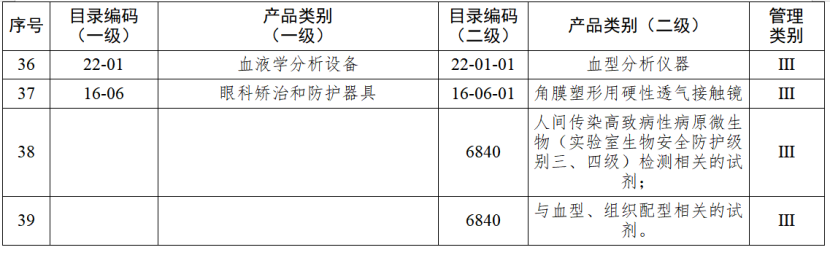
根据国家药品监督管理局《医疗器械生产重点监管品种目录》,结合江苏省医疗器械生产企业实际,省局制定《江苏省医疗器械生产重点监管品种目录》(以下简称《目录》)并进行动态调整。
《办法》明确,对医疗器械注册人备案人、受托生产企业的监管分为四个级别。
对风险程度高的企业实施四级监管,主要包括生产省局《目录》内四级监管医疗器械的企业,以及质量管理体系运行状况差、有严重不良监管信用记录的企业。
对风险程度较高的企业实施三级监管,主要包括生产省局《目录》内三级监管医疗器械的企业,未列入四级监管的所有第三类医疗器械生产企业,以及质量管理体系运行状况较差、有不良监管信用记录的企业。
对风险程度一般的企业实施二级监管,主要包括生产省局《目录》内二级监管医疗器械的企业,以及未列入省局《目录》的所有第二类医疗器械生产企业。
对风险程度较低的企业实施一级监管,主要包括生产省局《目录》外的所有第一类医疗器械生产企业。
同一医疗器械注册人备案人、受托生产企业持有注册证或受托生产的医疗器械产品类别涉及多个监管级别的,按照最高监管级别对该企业进行监管。
此外,对于当年内医疗器械注册人备案人、受托生产企业出现严重质量事故,或存在新增高风险产品、国家集中带量采购中选产品、创新产品等情况的,应当即时评估并将监管级别上调一级。对于长期以来监管信用状况较好的企业,药品监督管理部门可以将监管级别下调一级。
监管要求方面,《办法》规定, 对实施四级监管的企业,负责日常监管的药品监督管理部门每年至少组织一次全项目检查。对实施三级监管的企业,负责日常监管的药品监督管理部门每年至少组织一次检查,其中每两年全项目检查不少于一次。
对实施二级监管的企业,负责日常监管的药品监督管理部门每两年检查不少于一次。对实施一级监管的企业,负责日常监管的药品监督管理部门每年随机抽取本行政区域25%以上的企业进行监督检查,并对新增第一类医疗器械生产企业在生产备案之日起3个月内开展现场检查。
今年1月起,国家药监局综合司《关于加强医疗器械生产经营分级监管工作的指导意见》正式执行。
《指导意见》提出了对医疗器械生产经营企业的监管级别划分原则和检查要求,药品监管部门可以按照风险将医疗器械企业划分为四个监管级别,对不同监管级别的企业实施相应监管措施。
对于长期以来监管信用状况较好的企业,可以酌情下调监管级别;对于跨区域委托生产的医疗器械注册人,仅进行受托生产的受托生产企业,以及异地增设库房的经营企业等,应当酌情上调监管级别。
医疗器械生产监管坚持问题导向,综合运用监督检查、重点检查、跟踪检查、有因检查和专项检查等多种形式强化监督管理。监督检查可以采取非预先告知的方式进行,重点检查、有因检查和专项检查原则上采取非预先告知的方式进行。
医疗器械经营监管检查方式原则上应当采取突击性监督检查,鼓励采用现代信息技术手段实施监督管理,提高监管效率和水平。
医疗器械生产监管方面,国家药监局根据医疗器械产品风险程度制定并动态调整医疗器械生产重点监管品种目录;省、自治区、直辖市药品监督管理部门综合分析本行政区域同类产品注册数量、市场占有率、生产质量管理总体水平和风险会商情况等因素,对国家药品监督管理局制定的目录进行补充,确定本行政区域医疗器械生产重点监管品种目录并进行动态调整。
截至目前,国家及部分省份医疗器械生产重点监管品种目录已相继出台。分级监管之下,重点医疗器械的生产监管将进一步强化。
【声明】 本文内容转载,湖北省医疗器械行业协会不对其准确性及观点负责。如涉及版权问题请联系027-87839969,我们将立即处理,以保障各方权益。